कार्बन डाइऑक्साइड किसके साथ प्रतिक्रिया करता है। कार्बन डाइऑक्साइड
कार्बन डाइऑक्साइड (कार्बन डाइऑक्साइड, कार्बन डाइऑक्साइड, CO 2) दो तत्वों - ऑक्सीजन और कार्बन के मेल से बनता है। कार्बन डाइऑक्साइड का निर्माण तरल पदार्थ के किण्वन के परिणामस्वरूप हाइड्रोकार्बन यौगिकों या कोयले के दहन के दौरान होता है, और जानवरों और मनुष्यों के श्वसन के उत्पाद के रूप में भी होता है। वायुमंडल में यह कम मात्रा में निहित है। पौधे वातावरण से कार्बन डाइऑक्साइड को अवशोषित करते हैं और इसे कार्बनिक घटकों में बदलते हैं। यदि यह गैस पृथ्वी पर वायुमंडल से गायब हो जाती है, तो व्यावहारिक रूप से बारिश नहीं होगी और यह काफी ठंडा हो जाएगा।
कार्बन डाइऑक्साइड गुण
कार्बन डाइऑक्साइड हवा से भारी है। यह -78 ° C पर जम जाता है। ठंड होने पर, कार्बन डाइऑक्साइड बर्फ बनाता है। समाधान के रूप में, कार्बन डाइऑक्साइड कार्बोनिक एसिड बनाता है। कुछ गुणों के कारण, कार्बन डाइऑक्साइड को कभी-कभी पृथ्वी का "कंबल" कहा जाता है। यह पराबैंगनी किरणों को आसानी से पहुंचाता है। अवरक्त किरणों को कार्बन डाइऑक्साइड की सतह से बाहरी अंतरिक्ष में उत्सर्जित किया जाता है।
कार्बन डाइऑक्साइड उच्च तापमान पर तरल रूप में और उच्च दबाव में तरल रूप में जारी किया जाता है। कार्बन डाइऑक्साइड का गैसीय रूप अल्कोहल, अमोनिया के उत्पादन में अपशिष्ट गैसों से प्राप्त होता है, और ईंधन दहन के परिणामस्वरूप भी। कार्बन डाइऑक्साइड गैस एक गैर विषैले और गैर-विस्फोटक गैस है, गंधहीन और बेरंग है। तरल रूप में, कार्बन डाइऑक्साइड एक रंगहीन और गंधहीन तरल है। 5% से अधिक की सामग्री के साथ, कार्बन डाइऑक्साइड खराब हवादार कमरों में फर्श क्षेत्र में जमा होता है। हवा में ऑक्सीजन के वॉल्यूम अंश को कम करने से ऑक्सीजन की कमी और घुटन हो सकती है। भ्रूणविज्ञानियों ने पाया है कि मानव और पशु कोशिकाओं को लगभग 7% कार्बन डाइऑक्साइड और केवल 2% ऑक्सीजन की आवश्यकता होती है। कार्बन डाइऑक्साइड तंत्रिका तंत्र का एक ट्रैंक्विलाइज़र और एक उत्कृष्ट संवेदनाहारी है। मानव शरीर में गैस अमीनो एसिड के संश्लेषण में शामिल है, इसमें वासोडिलेटिंग प्रभाव होता है। रक्त में कार्बन डाइऑक्साइड की कमी से रक्त वाहिकाओं की ऐंठन और सभी अंगों की चिकनी मांसपेशियों की ओर जाता है, कोलेस्ट्रॉल के जमाव के कारण झिल्ली के कसने के लिए नाक मार्ग, ब्रोन्ची में स्राव में वृद्धि और पॉलीप्स और एडेनोइड्स का विकास होता है।
कार्बन डाइऑक्साइड का उत्पादन
कार्बन डाइऑक्साइड के उत्पादन के लिए कई तरीके हैं। उद्योग में, कार्बन डाइऑक्साइड डोलोमाइट, चूना पत्थर - प्राकृतिक कार्बोनेट के अपघटन उत्पादों, साथ ही भट्ठी गैसों से प्राप्त की जाती है। गैस मिश्रण को पोटेशियम कार्बोनेट के घोल से धोया जाता है। मिश्रण कार्बन डाइऑक्साइड को अवशोषित करता है और बाइकार्बोनेट में बदल जाता है। बाइकार्बोनेट घोल को गर्म किया जाता है और यह कार्बन डाइऑक्साइड को विघटित और छोड़ता है। एक औद्योगिक प्रक्रिया में, कार्बन डाइऑक्साइड को सिलेंडर में पंप किया जाता है।
प्रयोगशालाओं में, कार्बन डाइऑक्साइड का उत्पादन एसिड के साथ बाइकार्बोनेट और कार्बोनेट की बातचीत पर आधारित है।
कार्बन डाइऑक्साइड अनुप्रयोगों
रोजमर्रा के अभ्यास में, कार्बन डाइऑक्साइड का उपयोग अक्सर किया जाता है। खाद्य उद्योग में, कार्बन डाइऑक्साइड का उपयोग बेकिंग पाउडर के रूप में और परिरक्षक के रूप में किया जाता है। यह E290 कोड के तहत उत्पाद पैकेजिंग पर इंगित किया गया है। कार्बन डाइऑक्साइड के गुणों का उपयोग स्पार्कलिंग पानी के उत्पादन में भी किया जाता है।
जीव रसायन  पाया गया कि विभिन्न फसलों की उपज बढ़ाने के लिए कार्बन डाइऑक्साइड के साथ हवा को निषेचित करना बहुत प्रभावी है। हालांकि, इस उर्वरक विधि का उपयोग केवल ग्रीनहाउस में किया जा सकता है। कृषि में, कृत्रिम वर्षा बनाने के लिए गैस का उपयोग किया जाता है। एक क्षारीय वातावरण को बेअसर करते समय, कार्बन डाइऑक्साइड शक्तिशाली खनिज एसिड की जगह लेता है। सब्जी दुकानों में, कार्बन डाइऑक्साइड का उपयोग गैस वातावरण बनाने के लिए किया जाता है।
पाया गया कि विभिन्न फसलों की उपज बढ़ाने के लिए कार्बन डाइऑक्साइड के साथ हवा को निषेचित करना बहुत प्रभावी है। हालांकि, इस उर्वरक विधि का उपयोग केवल ग्रीनहाउस में किया जा सकता है। कृषि में, कृत्रिम वर्षा बनाने के लिए गैस का उपयोग किया जाता है। एक क्षारीय वातावरण को बेअसर करते समय, कार्बन डाइऑक्साइड शक्तिशाली खनिज एसिड की जगह लेता है। सब्जी दुकानों में, कार्बन डाइऑक्साइड का उपयोग गैस वातावरण बनाने के लिए किया जाता है।
इत्र उद्योग में, कार्बन डाइऑक्साइड का उपयोग इत्र के निर्माण में किया जाता है। दवा में, खुले संचालन के दौरान एंटीसेप्टिक प्रभाव के लिए कार्बन डाइऑक्साइड का उपयोग किया जाता है।
ठंडा होने पर, कार्बन डाइऑक्साइड "सूखी बर्फ" में बदल जाती है। तरलीकृत कार्बन डाइऑक्साइड को सिलेंडर में पैक किया जाता है और उपभोक्ताओं को भेजा जाता है। "सूखी बर्फ" के रूप में कार्बन डाइऑक्साइड का उपयोग भोजन को संरक्षित करने के लिए किया जाता है। गर्म होने पर ऐसी बर्फ बिना भाप के निकलती है।
कार्बन डाइऑक्साइड तार वेल्डिंग में एक सक्रिय माध्यम के रूप में उपयोग किया जाता है। वेल्डिंग करते समय, कार्बन डाइऑक्साइड ऑक्सीजन में विघटित हो जाता है और कार्बन मोनोऑक्साइड। ऑक्सीजन तरल धातु के साथ संपर्क करता है और इसे ऑक्सीकरण करता है।
विमान मॉडलिंग में, कार्बन डाइऑक्साइड का उपयोग इंजन के लिए ऊर्जा के स्रोत के रूप में किया जाता है। स्प्रे कैन में कार्बन डाइऑक्साइड का उपयोग एयरगन में किया जाता है।
बहुत बार, वह उन लोगों को मारता है जो खानों में काम करते हैं; आप तुरंत सेलर्स में उनके द्वारा गला घोंटा जा सकता है ”)।
3. कुछ खनिज पानी ("नींद का पानी जंगली हवा देते हैं")।
वैन हेलमोंट की इस खोज ने न्यूमेटोकेमिस्ट्री की नींव रखी। और यह वही वैन हेलमोंट, 5 साल के लिए जमीन की एक कम मात्रा में विलो का एक वजनदार शूट बढ़ रहा था और उसके बाद पृथ्वी के वजन में कमी के कारण यह निष्कर्ष नहीं निकला कि पौधों को पानी से बनाया जाता है जिसे वे एक मिनट के लिए सोचे बिना, लाभ का स्रोत है पौधे का वजन हवा या उससे खुलने वाली गैस हो सकती है।
एकमात्र परीक्षण वैन-हेलमॉन्ट ने उन्हें एक दूसरे से अलग करने के लिए अलग-अलग गैसों के अधीन किया था जो एक जलती हुई मोमबत्ती थी - एक उपकरण जो कार्बन डाइऑक्साइड को अलग करने के लिए अभी तक पर्याप्त नहीं है, उदाहरण के लिए, नाइट्रोजन से, जो दहन को बनाए रखने और घुटन वाले जीवों पर कार्य नहीं करता है, जैसा कि और वान हेलमोंट की "जंगली हवा"।
कार्बन डाइऑक्साइड की वह संपत्ति, जिसके द्वारा कार्बन डाइऑक्साइड को वास्तव में लगभग किसी भी अन्य गैस से अलग किया जा सकता है, चूने के पानी को "आकर्षित" करने और इसे हिलाए जाने की क्षमता, ब्लैक द्वारा खोजी गई थी; साधारण हवा से इस अंतर के लिए, ब्लैक ने जंगली गैस ("शायद बहुत दुर्भाग्यपूर्ण") को एक नया नाम दिया: निश्चित हवा।
कई वर्षों बाद, कैवेंडिश, "माप, संख्या और वजन" द्वारा सब कुछ निर्धारित करने के अपने नियम के लिए, कार्बन डाइऑक्साइड के दो और विशिष्ट भौतिक गुणों की खोज की: पानी में इसकी उच्च विशिष्ट गुरुत्व और महत्वपूर्ण घुलनशीलता।
इसके तुरंत बाद, लावोइसेयर ने एक प्रयोग किया, जिसे रासायनिक अनुसंधान को एक नई दिशा में निर्देशित करने के लिए नियत किया गया। हवा के उस घटक को सीसे के पैमाने से अलग करने के लिए, जो उसकी धारणा के अनुसार, लीड में शामिल हो गया और वजन में वृद्धि का कारण बना, Lavoisier ने कोयले के साथ लीड ऑक्साइड को शांत किया और एक गैस प्राप्त की जो पानी में अच्छी तरह से घुल गई, चूने के पानी को निकाला, लौ को बुझाया और जानवरों का गला घोंट दिया। एक शब्द में, "सभी गुण हवा के प्रकार में निहित समान हैं, जिन्हें निश्चित हवा के रूप में जाना जाता है"।
यह निश्चित वायु, अर्थात्। कार्बन डाइऑक्साइड, Lavoisier ने गलती से साधारण हवा के उस घटक के लिए पहली बार लिया, जो कि कैल्सीनेशन के दौरान धातुओं द्वारा जुड़ा हुआ है। वह निश्चित वायुमंडल वायु में समाहित है, ब्लैक पहले ही साबित हो चुका है: हवा में एक खुले बर्तन में बचा हुआ चूना पानी समय के साथ अशांत हो जाता है।
लवस्टियर को अपनी गलती का अहसास प्रिस्टले से मिलने के बाद ही हुआ, जिसने बिना शक के "पारा स्केल" के साथ अपने अनुभव के माध्यम से पहले से ही उस समस्या को हल कर लिया था जो कि लवॉज़ियर लड़ रहा था। Lavoisier ने तुरंत कोयले के साथ धातु के पैमाने को कम करने के अपने अनुभव को दोहराया, केवल पारा ऑक्साइड के साथ सीसा ऑक्साइड को प्रतिस्थापित किया और इस बार सही व्याख्या दी: “चूंकि कोयला अपने पैमाने से पारा की कमी के दौरान पूरी तरह से गायब हो जाता है और चूंकि यह ऑपरेशन केवल पारा और निश्चित हवा का उत्पादन करता है, क्योंकि हवा कोयले के साथ महत्वपूर्ण वायु (ऑक्सीजन) का एक संयोजन है, अर्थात। कार्बन ऑक्साइड (ऑक्साइड)। ”
2.2 कार्बन डाइऑक्साइड अणु की संरचना
2.2.1 विमान की स्थिति से
कार्बन मोनोऑक्साइड (IV) अणु में निम्नलिखित संरचना होती है: कार्बन परमाणु एक उत्तेजित अवस्था में जाता है, जिसमें 4 अप्रकाशित इलेक्ट्रॉन होते हैं।
C +6)) 1s 2 2s 2 2p 2 Yu C * +6)) 1s 2 2s 1 2p 3
O +8)) 1s 2 2s 2 2p 4
श्री (सीओ 2) \u003d 12.011 + 15.999 · 2 \u003d 44.009 ”44
कार्बन मोनोऑक्साइड अणु (IV) में दो ऑक्सीजन परमाणु और एक कार्बन परमाणु होते हैं।
इलेक्ट्रॉनिक सूत्र संरचनात्मक सूत्र
·· · · ··
ओ · सी · शोधकर्ता ओ ओ \u003d सी \u003d ओ
·· ґ ґ ··
सभी 4 सहसंयोजक बंधन ध्रुवीय हैं। अणु का एक रैखिक आकार होता है। इसे निम्नानुसार समझाया गया है: पॉलीऐटोमिक अणुओं में, परमाणुओं के बीच का बंधन ध्रुवीय हो सकता है, और स्वयं अणु, स्थानिक संरचना के आधार पर, ध्रुवीय या गैर-ध्रुवीय हो सकते हैं। ऐसे अणुओं में द्विध्रुवीय का विद्युत क्षण ध्रुवीय बंधों की संख्या और उनकी प्रत्यक्षता से निर्धारित होता है। यह व्यक्तिगत बंधों के द्विध्रुवीय क्षणों के वेक्टर योग के बराबर है। उदाहरण के लिए, बॉन्ड्स के द्विध्रुवीय गति C \u003d O 9 · 10 -30 C · m है, और CO 2 अणु शून्य है। क्योंकि एक रैखिक सीओ 2 अणु में, बंधन वैक्टर केंद्र से रेडियल रूप से निर्देशित होते हैं, और इसलिए परिणामी पल एम शून्य होता है।
सी डी +
ओ डी - ओ डी -
चित्र 1। कार्बन डाइऑक्साइड अणु में बांड द्विध्रुवीय के विद्युत क्षणों का ज्यामितीय जोड़
चूंकि कार्बन-ऑक्सीजन बांड में से प्रत्येक ध्रुवीय है, इसलिए, प्रत्येक ऑक्सीजन परमाणु में कुछ नकारात्मक चार्ज होना चाहिए, और एक सकारात्मक चार्ज कार्बन पर केंद्रित है। चूंकि ऑक्सीजन परमाणु समान दूरी पर कार्बन परमाणु के दोनों ओर एक सीधी रेखा पर स्थित होते हैं, सकारात्मक और नकारात्मक आवेशों के वितरण केंद्र संयोग करते हैं। नतीजतन, कार्बन पर आरोप पूरी तरह से बेअसर है।
इसलिए, हालांकि प्रत्येक कार्बन-ऑक्सीजन बांड ध्रुवीय है, एक पूरे के रूप में कार्बन डाइऑक्साइड अणु गैर-ध्रुवीय है और इसका कारण इसकी रैखिक संरचना है।
2.2.2 MLCAO के दृष्टिकोण से
हम जानते हैं कि कार्बन डाइऑक्साइड अणु का आकार रैखिक है। ऑक्सीजन परमाणु में पी-टाइप ऑर्बिटल्स हैं।
चित्र 2 केंद्रीय परमाणु (कार्बन) के वैलेन्स ऑर्बिटल्स और लिगैंड्स (ऑक्सीजन परमाणु) के समूह ऑर्बिटल्स को दर्शाता है।
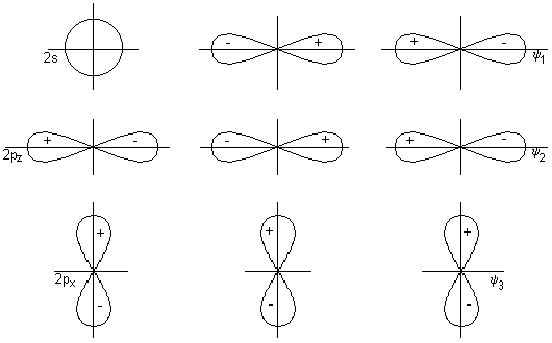
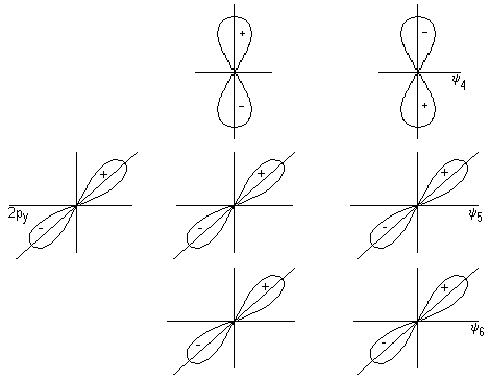
अंजीर। २। सीओ 2 के तीन-केंद्र रैखिक अणु के लिए केंद्रीय परमाणु (ए) समूह ऑर्बिटल्स (बी) की कक्षाएं।
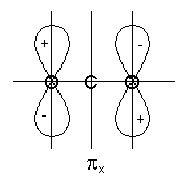
2s और 2p ऑक्सीजन ऑर्बिटल्स के बीच बड़े ऊर्जा अंतर के कारण, 2s ऑर्बिटल्स की भागीदारी को उपेक्षित किया जा सकता है। 2s-y 1, 2p z -y 2 ऑर्बिटल्स का संयोजन एस-प्रकार आणविक ऑर्बिटल्स के गठन की ओर जाता है: s s b, s s और s z b, s z bit।
चित्र 3। कार्बन डाइऑक्साइड बाध्यकारी और एस-ऑर्बिटल्स को ढीला करता है
2p x -y 3 और 2p y -y 5 ऑर्बिटल्स के संयोजन से तीन-केंद्र p-type ऑर्बिटल्स का निर्माण होता है: p x cp, p x pit और p y cf, p y pit (Fig। 4)। समूह 4 की कक्षा 4 और y 6 के लिए समरूपता के लिए उपयुक्त कोई केंद्रीय परमाणु नहीं हैं, इसलिए, सीओ 2 अणु में वे गैर-बाँधने की भूमिका निभाते हैं और पी एक्स और पी वाई द्वारा निरूपित किए जाते हैं। गैर-बाध्यकारी ऑर्बिटल्स ऑक्सीजन परमाणुओं में स्थानीयकृत हैं (चित्र 4)
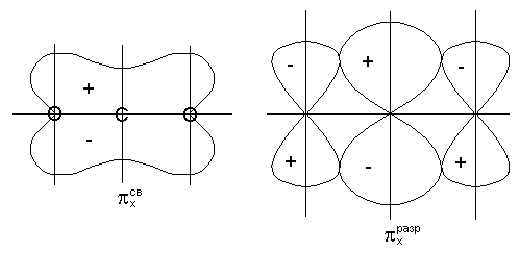
चित्र 4। CO-2 अणु के p -binding, ढीले और गैर-बाध्यकारी ऑर्बिटल्स।
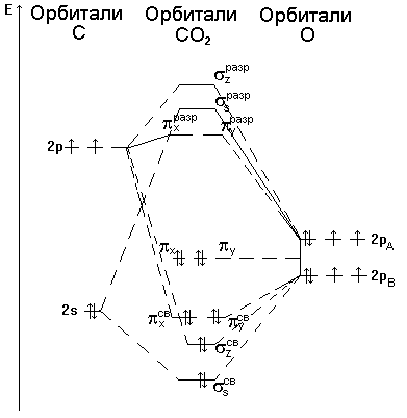
सीओ 2 अणु का एक अनुमानित ऊर्जा आरेख चित्र 5 में दिखाया गया है। सीओ 2 अणु की कक्षाओं के ऊपर वैलेंस इलेक्ट्रॉनों (चार कार्बन परमाणु और आठ से दो ऑक्सीजन परमाणु) का वितरण इलेक्ट्रॉनिक कॉन्फ़िगरेशन से मेल खाता है
(s z sv) 2 (s z sv) 2 (p x sv) 2 (p y sv) 2 (p x) 2 (p y) 2,
और दो ऑक्सीजन परमाणुओं के 2s-इलेक्ट्रॉनों को ध्यान में रखते हुए
(2 एस ए) 2 (2 एस बी) 2 (एस सेंट) 2 (एस जेड सेंट) 2 (पी एक्स, वाई) 4 (पी एक्स, वाई) 4।
इलेक्ट्रॉनों के चार जोड़े चार तीन-केंद्र बंधन कक्षा पर गिरते हैं, अर्थात्। ऑक्सीजन परमाणुओं में से प्रत्येक में बाध्यकारी इलेक्ट्रॉनों के दो जोड़े हैं। इस प्रकार, हम मान सकते हैं कि सीओ 2 अणु में ऑक्सीजन और कार्बन परमाणुओं के बीच बंधन क्रम 2 है। यह संरचनात्मक सूत्र O \u003d C \u003d O में परिलक्षित हो सकता है।
2.3 कार्बन डाइऑक्साइड के भौतिक गुण
कार्बन डाइऑक्साइड (कार्बन मोनोऑक्साइड (IV) या कार्बोनिक एनहाइड्राइड) एक रंगहीन गैस है जिसमें थोड़ी अम्लीय गंध और स्वाद होता है, जो ऑक्सीजन की तुलना में 1.5 गुना भारी है, इसलिए आप इसे ग्लास से ग्लास में डाल सकते हैं। आर \u003d 1.98 ग्राम / एल। सीओ 2 के 0.88 खंडों को 20 डिग्री सेल्सियस पर पानी की एक मात्रा में भंग कर दिया जाता है। जब सामान्य दबाव में ठंडा किया जाता है, तो तरल अवस्था को दरकिनार करते हुए गैस -78.515 ° C पर जम जाती है। ठोस कार्बन मोनोऑक्साइड (IV) एक बर्फीला द्रव्यमान है जिसे शुष्क बर्फ कहा जाता है। तरल सीओ 2 केवल 20 डिग्री सेल्सियस पर दबाव में बनता है; 58.4610 5 पा। एक तरल अवस्था में इसे स्टील सिलेंडरों में संग्रहित और परिवहन किया जाता है। सिलेंडर वाल्व खोलते समय, मजबूत शीतलन होता है और गैस का हिस्सा सूखी बर्फ में गुजरता है। उदात्त करने के लिए आसान, कठोर। वाष्प दबाव: 133.32Pa (-135.1 डिग्री सेल्सियस); 1.3332 kPa (-119.6 ° C); 13.332 केपीए (-100.2 डिग्री सेल्सियस); 53.328 केपीए (-86.0 डिग्री सेल्सियस)। टी MP \u003d -56.6 ° C (0.52 MPa)। मानव सीरम में घुलनशीलता गुणांक 0.58 है। हवा में सीओ 2 की मात्रा से 4% की सामग्री एक दर्दनाक घटना का कारण बनती है, जब सीओ 2 की एकाग्रता 10% से ऊपर होती है, घुटन दिखाई देती है।
कार्बन मोनोऑक्साइड (IV) पौधों और जानवरों की श्वसन और साथ ही दहन, श्वसन, क्षय, किण्वन की प्रक्रियाओं का अंतिम उत्पाद है। यह हरे पौधों के लिए पोषण के स्रोत के रूप में कार्य करता है - प्रकाश संश्लेषण।
कार्बन डाइऑक्साइड रंगहीन है, अर्थात किसी भी दृश्य किरणों को अवशोषित नहीं करता है। लेकिन कार्बन डाइऑक्साइड के स्पेक्ट्रम के अवरक्त भाग में, व्यापक अवशोषण लाइनें देखी जाती हैं; अवरक्त के लिए, दूसरे शब्दों में, थर्मल किरणों, कार्बन डाइऑक्साइड थोड़ा पारदर्शी है। इसलिए, यदि पृथ्वी के वायुमंडल में कार्बन डाइऑक्साइड शामिल है, तो यह ग्रीनहाउस में कांच की भूमिका निभाएगा, सौर विकिरण इसके माध्यम से पृथ्वी की सतह पर बिना किसी ध्यान देने योग्य क्षीणन के पहुंचेगा, और इसे बहुत गर्म करेगा, लेकिन विश्व अंतरिक्ष में पृथ्वी के रिवर्स थर्मल विकिरण में बहुत देरी होगी। कार्बन डाइऑक्साइड किरणों को गर्म करने के लिए पारदर्शी। इससे, पृथ्वी की जलवायु तेजी से गर्म हो गई ("ग्रीनहाउस प्रभाव", अध्याय "भूगोल")।
2.4 कार्बन डाइऑक्साइड के रासायनिक गुण
कार्बन मोनोऑक्साइड (IV) रासायनिक रूप से काफी सक्रिय है। आइए कुछ प्रतिक्रियाओं पर विचार करें।
1. कार्बन मोनोऑक्साइड (IV) - एसिड ऑक्साइड, यह डिबासिक कार्बोनिक एसिड से मेल खाती है। कार्बन मोनोऑक्साइड (IV) का विघटन एक प्रतिवर्ती प्रतिक्रिया है।
एच 2 ओ + सीओ 2 एच 2 सीओ 3
कमरे के तापमान पर संतुलन 99% बाईं ओर स्थानांतरित कर दिया गया है
कार्बन डाइऑक्साइड केवल पानी में नहीं घुलता है, बल्कि आंशिक रूप से इसके साथ मिलकर कार्बोनिक एसिड बनाता है।
2H 2 O + CO 2 H 3 O + + HCO 3 -
हालांकि, कार्बोनिक एसिड एक अत्यंत नाजुक यौगिक है। यह केवल एक जलीय घोल में मौजूद हो सकता है, लेकिन किसी घोल से कार्बोनिक एसिड को अलग करने के किसी भी प्रयास में, यह फिर से सीओ 2 और एच 2 ओ में विघटित हो जाता है।
H 2 CO 3 H + + HCO 3 Ka I \u003d 4.45 · 10 -7
HCO 3 - H + + CO 3 Ka II \u003d 4.6910 -11
2. मजबूत आधारों के साथ, कार्बन मोनोऑक्साइड (IV) कार्बोनिक लवण - कार्बोनेट और बाइकार्बोनेट के गठन के साथ प्रतिक्रिया करता है।
सीए (ओएच) 2 + सीओ 2 ® सीएसीओ ३ H + एच २ ओ
सीएसीओ 3 + एच 2 ओ + सीओ 2 ® सीए (एचसी 3 3) 2
3. कार्बन डाइऑक्साइड - एक बहुत मजबूत पदार्थ, हालांकि, कैल्शियम के साथ लाल गर्मी के तापमान पर कार्बाइड और कैल्शियम ऑक्साइड देता है।
2CO 2 + 5Ca® CaC 2 + 4CaO
4. कार्बन मोनोऑक्साइड (IV) में सबसे सक्रिय धातुएं जलती हैं।
600 ° से
2 एमजी + सीओ 2 ® 2 एमजीओ + सी
5. उच्च तापमान पर, यह लोहे, जस्ता, कोयले के साथ सीओ तक कम हो जाता है।
3CO 2 + 4Fe® 2Fe 2 O 3 + 3C
CO 2 + C® 2CO
6. 350-400 ° C पर निकेल की उपस्थिति में हाइड्रोजन के साथ या 200 ° C पर कॉपर ऑक्साइड (II) यह मीथेन में कम हो जाता है।
350-400 ° से
सीओ 2 + 4 एच 2 ® सीएच 4 + 2 एच 2 ओ
7. 600 ° C पर अमोनिया के साथ यूरिया देता है।
सीओ 2 + एनएच 3® सीओ (एनएच 2) 2
8. तांबे की उपस्थिति में कार्बन डाइसल्फ़ाइड के साथ
CO 2 + CS 2® 2S + 2CO
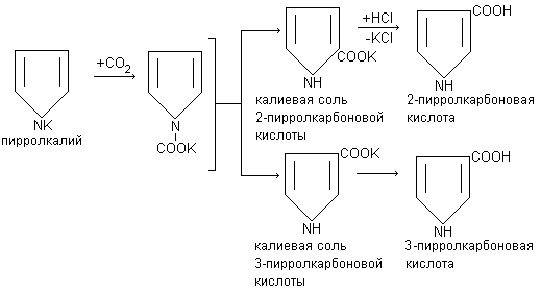
9. कई कार्बनिक यौगिकों के साथ प्रतिक्रिया करता है, उन्हें कार्बोक्सिलेटिंग करता है। फिनोल की तरह, पाइरोल को कार्बन मोनोऑक्साइड (IV) के साथ कार्बोक्सिलेटेड किया जाता है, जिससे 2-पाइरोले कार्बोक्जिलिक एसिड बनता है, और अधिक कड़े तापमान की स्थिति में, 3-पाइरोले कार्बोक्जिलिक एसिड।
2.5 कार्बन डाइऑक्साइड का उत्पादन
रासायनिक प्रयोगशालाओं में, वे या तो तरल कार्बोनिक एनहाइड्राइड के साथ तैयार सिलेंडर का उपयोग करते हैं, या उन्हें संगमरमर के टुकड़ों पर हाइड्रोक्लोरिक एसिड की कार्रवाई से किप्स के तंत्र में कार्बन डाइऑक्साइड मिलता है। हाइड्रोक्लोरिक एसिड के बजाय सल्फ्यूरिक एसिड का उपयोग करना असंभव है, क्योंकि तब पानी में घुलनशील कैल्शियम क्लोराइड के बजाय जिप्सम निकला होगा - एक नमक जो पानी में खराब घुलनशील है। संगमरमर के टुकड़ों में जमा होने के कारण, जिप्सम उन तक एसिड की पहुंच को जटिल बनाता है और इस तरह प्रतिक्रिया के दौरान बहुत धीमा हो जाता है। कार्बन डाइऑक्साइड को पानी से धोने वाले फ्लास्क में हाइड्रोजन क्लोराइड वाष्प की अशुद्धता और अगले फ्लास्क में सल्फ्यूरिक एसिड के साथ जल वाष्प से मुक्त किया जाता है।
उद्योग में, कार्बन डाइऑक्साइड मुख्य रूप से चूना पत्थर, मादक किण्वन के उपोत्पाद के रूप में प्राप्त किया जाता है।
2.6 कार्बन डाइऑक्साइड अनुप्रयोग
जी। कैवेंडिश सबसे पहले इस तथ्य पर ध्यान आकर्षित करने वाले थे कि कार्बन डाइऑक्साइड के एक जलीय घोल में कमजोर लेकिन सुखद खट्टा स्वाद होता है। उन्होंने रॉयल सोसाइटी में एक ग्लास "बेहद सुखद स्पार्कलिंग (शानदार) पानी, शायद ही पानी के पानी से अलग" का प्रदर्शन किया और इस खोज के लिए समाज का एक स्वर्ण पदक प्राप्त किया। यह कार्बन डाइऑक्साइड का पहला व्यावहारिक उपयोग था, अमेरिकी व्यवसायी इसमें रुचि रखते थे (जब डी। प्रीस्टली पहले से ही निर्वासन में थे), एक के बाद एक डॉक्टर ने अपने रोगियों को फलों के रस के अलावा कार्बोनेटेड पानी को लिखना शुरू किया। यहीं से कार्बोनेटेड पेय उद्योग का विकास शुरू हुआ, जो अभी भी कार्बन डाइऑक्साइड के सबसे महत्वपूर्ण उपभोक्ताओं में से एक है।
कार्बन डाइऑक्साइड का उपयोग चीनी और फलों के पानी को कार्बोनेट करने के लिए किया जाता है, चीनी, बीयर और कार्बन डाइऑक्साइड स्नान के लिए दवा के उत्पादन के लिए। यह कार्बन डाइऑक्साइड के तरल द्रव्यमान वाले छोटे स्टील सिलेंडर से जीवन बेल्ट और राफ्ट से भर जाता है। तरल कार्बोनिक एनहाइड्राइड का उपयोग किया जाता है:
1) पोर्टेबल आग बुझाने की कल में;
2) विमान और जहाजों की आग बुझाने की प्रणालियों में, कार्बन डाइऑक्साइड अग्नि इंजन।
आग बुझाने में इस तरह के व्यापक उपयोग इस तथ्य के कारण है कि कुछ मामलों में पानी बुझाने के लिए उपयुक्त नहीं है, उदाहरण के लिए, जब ज्वलनशील ज्वलनशील तरल पदार्थों को बुझाने या कमरे में असंबद्ध विद्युत तारों की उपस्थिति में, अद्वितीय उपकरण जो पानी से प्रभावित हो सकते हैं।
दबाए गए ठोस कार्बोनिक एनहाइड्राइड, जिसे हम सूखी बर्फ कहते हैं, का उपयोग भी काफी व्यापक है। तो इसका उपयोग पेरिशेबल उत्पादों के परिवहन के लिए और साथ ही साथ आइसक्रीम के उत्पादन के लिए प्रशीतित कारों में कम तापमान बनाए रखने के लिए किया जाता है। क्यों, सवाल उठता है, आप साधारण बर्फ का उपयोग नहीं कर सकते। और यह पता चला कि सूखी बर्फ के कई फायदे हैं:
1. आपको रेफ्रिजरेटर में बनाए रखने की अनुमति देता है, जिसमें आइसक्रीम बेचने वाले की भूमिका एक साधारण कार्डबोर्ड बॉक्स, -78.2 ° C से बहुत कम तापमान पर होती है;
2. पिघलने के दौरान बर्फ की तुलना में वाष्पीकरण के दौरान प्रति यूनिट द्रव्यमान का तीन गुना अधिक गर्मी अवशोषित करता है;
3. तरल पिघलने वाले उत्पाद के साथ, साधारण बर्फ की तरह रेफ्रिजरेटर को प्रदूषित नहीं करता है;
4. फ्रिज में कार्बन डाइऑक्साइड का एक वातावरण बनाता है, जो भोजन को खराब होने से बचाता है।
सूखी मिश्र धातु का उपयोग एल्यूमीनियम मिश्र धातुओं से ठंडा और कड़ा होने के लिए भी किया जाता है और जब बैंडेज - धातु के छल्ले या बेल्ट को मशीन भागों में दान किया जाता है।
कार्बन डाइऑक्साइड का उपयोग ग्रेफाइट रिएक्टरों में शीतलक के रूप में भी किया जाता है।
बदलते मौसम के लिए कार्बन मोनोऑक्साइड IV का एक बहुत ही दिलचस्प अनुप्रयोग: जब सूखे बर्फ के पाउडर को एक सुपरक्यूलर क्लाउड पर उड़ान भरने वाले हवाई जहाज से फैलाया जाता है, तो एयरफ़िल्ड (केवल 1 इंच 3 मीटर प्रति बर्फ की 100 ग्राम की दर से) पर कृत्रिम बर्फबारी बनाई जाती है। इसी समय, बर्फ के मोटे गीले गुच्छे गिरने लगते हैं और जल्द ही बादलों के माध्यम से आकाश में चमकने लगती है। Gleams तेजी से विस्तार करते हैं और एक विस्तृत नीले आकाश में विलय करते हैं। मजबूत शीतलन के परिणामस्वरूप, केवल कुछ पानी की बूंदें जम जाती हैं। बाकी सब एक सुपरकूल अवस्था में हैं। लेकिन चूंकि एक ही तापमान पर सुपरकोलड पानी में बर्फ की तुलना में अधिक वाष्प दबाव होता है, लिक्विड पानी की बूंदों के कारण बर्फ के क्रिस्टल तुरंत बढ़ने लगते हैं, जिससे बर्फबारी होती है।
कई मामलों में, कार्बोनिक एनहाइड्राइड का उपयोग समाप्त रूप में नहीं किया जाता है, लेकिन उपयोग के दौरान प्राप्त किया जाता है। ऐसे मामलों में, शुरुआती सामग्रियों को या तो अलग से उपयोग किया जाता है - पारंपरिक अग्निशामक में सल्फ्यूरिक एसिड और सोडियम डाइकार्बोनेट के रूप में, या दो सूखे पाउडर (कुछ बेकिंग पाउडर में) के मिश्रण के रूप में, उदाहरण के लिए, अम्लीय पोटेशियम टार्ट्रेट, अमोनियम टारटेट या अमोनियम क्लोराइड के साथ सोडियम बाइकार्बोनेट का मिश्रण। जबकि यह मिश्रण सूखा रहता है, प्रतिक्रिया नहीं होती है। जब पानी डाला जाता है, तो लवण घुल जाता है, विघटित हो जाता है और कार्बन डाइऑक्साइड की रिहाई के साथ एक आयनिक प्रतिक्रिया होती है।
जैविक एजेंटों - खमीर और स्टार्टर संस्कृतियों के उपयोग के बिना, आटा को रासायनिक रूप से ढीला करने के लिए आटा के साथ बेकिंग पाउडर के मिश्रण के परिणामस्वरूप समान प्रतिक्रियाएं होती हैं। नतीजतन, आटा "उगता है", कार्बन डाइऑक्साइड के बुलबुले से भरता है, और इससे पका हुआ उत्पाद नरम और पचाने में आसान होता है।
कार्बन डाइऑक्साइड एक निष्क्रिय वातावरण के रूप में कार्य करता है।
इस तरह के व्यापक उपयोग में कार्बन मोनोऑक्साइड (IV) है। इसके सर्वोत्तम गुण यहां दिखाए गए हैं, लेकिन सभी कार्बन डाइऑक्साइड मनुष्य और प्रकृति के लिए उपयोगी नहीं हैं।
2.7 प्रकृति में कार्बन चक्र
ग्रीन कार्बन के इतिहास में, कई चरणों को प्रतिष्ठित किया जा सकता है। पृथ्वी के पानी के खोल की उपस्थिति से पहले, कार्बन मुख्य रूप से कार्बन डाइऑक्साइड के रूप में पृथ्वी के वायुमंडल का हिस्सा था। यह सिलिकेट खनिजों में गैस समावेशन के विश्लेषण से स्पष्ट होता है: ऑक्सीजन उनमें अनुपस्थित है, और कार्बन डाइऑक्साइड सामग्री 96% है। पृथ्वी की पपड़ी के ठंडा होने और कार्बन डाइऑक्साइड के साथ संतृप्त तरल पानी की उपस्थिति के साथ, आग्नेय चट्टानों के अपक्षय की प्रक्रिया शुरू होती है, जो मुख्य रूप से कार्बोनिक एसिड द्वारा सिलिकेट से सिलिकिक एसिड के विस्थापन के लिए एक मजबूत एसिड के रूप में नीचे आती है। ढीले द्रव्यमान के रूप में रॉक विनाश के अघुलनशील उत्पाद शीट पर रहते हैं, और घुलनशील लवण, जिसमें डाइकार्बोनेट्स शामिल हैं, को दुनिया के समुद्र में ले जाया जाता है। यह पौधे के जीवित पदार्थ के उद्भव के लिए परिस्थितियों का आवश्यक संयोजन बनाता है: कार्बन डाइऑक्साइड, तरल पानी और इसमें भंग लवण।
महासागरों में, जीवन का जन्म हुआ; यह कार्बन के भू-रासायनिक जीवन में एक नए चरण की शुरुआत है। पौधे के जीवन की मूल प्रक्रिया के परिणामस्वरूप - प्रकाश संश्लेषण - वातावरण से कार्बन जीवमंडल के जीवित द्रव्यमान में गुजरता है, और वायुमंडल की संरचना धीरे-धीरे बदलती है, इसमें कार्बन डाइऑक्साइड ऑक्सीजन द्वारा प्रतिस्थापित किया जाता है। इस प्रकार, पशु जीवन के उद्भव के लिए आवश्यक पूर्वापेक्षाएँ उत्पन्न होती हैं: पौधों द्वारा संचित मुक्त ऑक्सीजन और कार्बनिक पदार्थ।
यह आंकड़ा एक पूरी तस्वीर में प्रकृति में कार्बन डाइऑक्साइड के रूपांतरण के व्यक्तिगत रूपांतरणों को एक साथ लाता है।
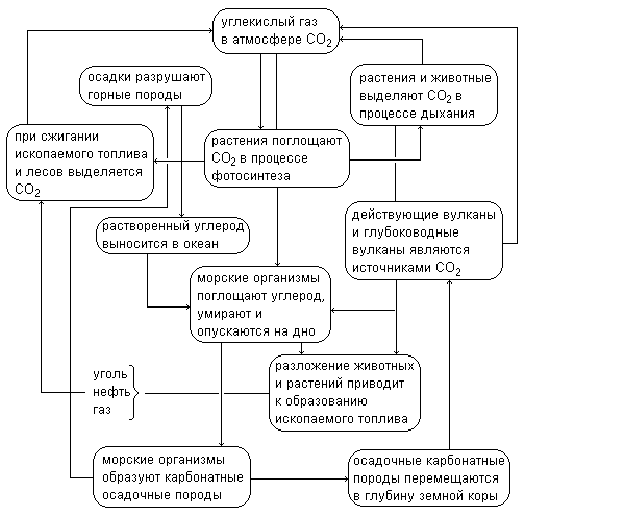
कार्बनिक पदार्थों को बनाने के लिए कार्बन डाइऑक्साइड का उपयोग प्रकाश संश्लेषण की प्रक्रिया में किया जाता है। यह इस प्रक्रिया के लिए धन्यवाद है कि जीवमंडल में कार्बन चक्र बंद हो जाता है। ऑक्सीजन की तरह, कार्बन मिट्टी, पौधों, जानवरों का एक हिस्सा है, प्रकृति में पदार्थों के संचलन के विभिन्न तंत्रों में भाग लेता है। हम जिस हवा में सांस लेते हैं उसमें कार्बन डाइऑक्साइड की मात्रा ग्रह के विभिन्न हिस्सों में लगभग समान होती है। अपवाद बड़े शहर हैं जिनमें हवा में इस गैस की सामग्री सामान्य से अधिक है।
इलाके की हवा में कार्बन डाइऑक्साइड की मात्रा में कुछ उतार-चढ़ाव दिन के समय, वर्ष के मौसम और वनस्पति के बायोमास पर निर्भर करते हैं। इसी समय, अध्ययन से पता चलता है कि सदी की शुरुआत के बाद से, वातावरण में कार्बन डाइऑक्साइड की औसत सामग्री, हालांकि धीरे-धीरे लेकिन लगातार बढ़ रही है। वैज्ञानिक इस प्रक्रिया को मुख्य रूप से मानवीय गतिविधियों से जोड़ते हैं।
प्रत्येक रासायनिक तत्व की तरह, पृथ्वी की पपड़ी में कार्बन निरंतर गति में है, यौगिकों के एक रासायनिक रूप से दूसरे में बदलना; ये परिवर्तन पारस्परिक रूप से चक्रण के पूरे सिस्टम में बंद हैं। कार्बन 2 के एक विशिष्ट रूप से आगे बढ़ते हुए, उदाहरण के लिए CO 2 से, और क्रमिक रूप से इसके परिवर्तनों को ट्रेस करते हुए, हम फिर से प्रारंभिक बिंदु - CO 2 पर लौट आएंगे।
खनिज प्रकृति में, कार्बन डाइऑक्साइड के मुख्य जनरेटर ज्वालामुखी हैं, न केवल सक्रिय हैं, बल्कि लंबे समय तक विलुप्त भी हैं; ज्वालामुखीय क्षेत्र भूमिगत और कुंजियों से निकलने वाले कार्बन डाइऑक्साइड जेट के साथ प्रचुर मात्रा में होते हैं जो कार्बन डाइऑक्साइड (अक्सर उच्च दबाव में) से संतृप्त समाधान के रूप में पृथ्वी के आंतरिक भाग से सीओ 2 का उत्सर्जन करते हैं।
खनिज प्रकृति में, कार्बन डाइऑक्साइड का सेवन अपक्षय प्रक्रियाओं द्वारा किया जाता है। ये बेहद धीमी रासायनिक प्रतिक्रियाएं हैं; हम सीधे उनके पाठ्यक्रम का पता नहीं लगा सकते। लेकिन जब हम अपक्षय के द्वारा नष्ट हो चुकी गहरी चट्टानों से मिलते हैं, उदाहरण के लिए, इसके विनाश के उत्पादों से घिरे ग्रेनाइट - रेत और मिट्टी, हम आसानी से मानसिक रूप से विनाश की प्रक्रिया को फिर से बना सकते हैं, हर बार आक्रामकता चट्टान को कार्बन डाइऑक्साइड में बदलने वाली आक्रामकता में आवश्यक भागीदार। इस प्रकार, कार्बन जियोकेमिस्ट्री के दृष्टिकोण से, अपक्षय प्रक्रिया कार्बन डाइऑक्साइड बाध्यकारी प्रक्रियाएं हैं। यह कार्बन डाइऑक्साइड है जो अपक्षय प्रक्रियाओं में मुख्य अभिनेता है, और चूंकि वे सर्वव्यापी हैं और खनिज पदार्थों के बड़े पैमाने पर बड़े पैमाने पर कवर करते हैं, कार्बन डाइऑक्साइड को वातावरण से इतनी बड़ी मात्रा में निकाला जाता है कि, भूवैज्ञानिकों की गणना के अनुसार, वातावरण में मौजूद कार्बन डाइऑक्साइड। अपक्षय प्रक्रियाओं के लिए 18,000 वर्ष से अधिक नहीं।
कार्बन डाइऑक्साइड के साथ वातावरण को फिर से भरने और उपभोग करने वाली प्रक्रियाओं के पैमाने को ग्लोब टेबल के अस्तित्व के आधुनिक युग में प्रस्तुत किया गया है:
कार्बन एनहाइड्राइड चक्र की परिमाण (प्रति वर्ष अरब टन)।
| वायुमंडलीय रिलीज | वायुमंडल से बच जाते हैं |
| महासागरों से २०० | महासागरों के लिए 200 |
| सांस लेना और सड़ना 60 | प्रकाश संश्लेषण 60 |
| हॉट स्प्रिंग्स और ज्वालामुखी 0.1 | अपक्षय 0.1 |
| ईंधन दहन ६ | |
| कुंवारी भूमि का विकास इसी तरह के निबंध। कार्बन डाइऑक्साइड (कार्बन डाइऑक्साइड , कार्बन डाइऑक्साइड , कार्बन ऑक्साइड (IV) , कार्बोनिक एनहाइड्राइड , कार्बन डाइऑक्साइड) - सीओ 2, एक रंगहीन गैस जिसमें थोड़ा खट्टा गंध और स्वाद होता है। सामान्य परिस्थितियों में घनत्व 1.98 ग्राम / लीटर है। वायुमंडलीय दबाव में, यह एक तरल अवस्था में मौजूद नहीं होता है, एक ठोस अवस्था से सीधे एक गैसीय अवस्था में गुजरता है। ठोस कार्बन डाइऑक्साइड को सूखी बर्फ कहा जाता है। सूखी बर्फ का उपयोग प्रशीतक के रूप में किया जाता है। उच्च दबाव और सामान्य तापमान पर, कार्बन डाइऑक्साइड तरल में गुजरता है, जिसका उपयोग इसे स्टोर करने के लिए किया जाता है। पर रासायनिक गुण कार्बन डाइऑक्साइड को संदर्भित करता है एसिड ऑक्साइड। पानी में घुलने पर कार्बोनिक एसिड बनता है। कार्बोनेट और बाइकार्बोनेट के गठन के साथ क्षार के साथ प्रतिक्रिया करता है। यह इलेक्ट्रोफिलिक प्रतिस्थापन प्रतिक्रिया में प्रवेश करता है (उदाहरण के लिए, फिनोल के साथ - कोल्बे प्रतिक्रिया) और न्यूक्लियोफिलिक जोड़ (उदाहरण के लिए, ऑर्गोमैग्नीशियम यौगिकों के साथ)। कार्बन डाइऑक्साइड नहीं विषाक्त लेकिन सांस लेने का समर्थन नहीं करता है। हवा में एक उच्च एकाग्रता घुटन का कारण बनता है। कार्बन डाइऑक्साइड पौधों के लिए मुख्य कार्बन स्रोत है। पृथ्वी के वायुमंडल में कार्बन डाइऑक्साइड की सांद्रता 0.038% है। कार्बन डाइऑक्साइड आसानी से स्पेक्ट्रम के दृश्य भाग की पराबैंगनी किरणों और किरणों को प्रसारित करता है, जो सूर्य से पृथ्वी में प्रवेश करते हैं और इसे गर्म करते हैं। एक ही समय में, यह पृथ्वी द्वारा उत्सर्जित अवरक्त किरणों को अवशोषित करता है और एक ग्रीनहाउस गैस है। स्वागत उद्योग में, उन्हें प्राकृतिक कार्बोनेट (चूना पत्थर, डोलोमाइट) के अपघटन उत्पादों से भट्ठी गैसों से प्राप्त किया जाता है। गैस मिश्रण को पोटेशियम कार्बोनेट के समाधान से धोया जाता है, जो कार्बन डाइऑक्साइड को अवशोषित करता है, बाइकार्बोनेट में गुजरता है। गर्म होने पर, बाइकार्बोनेट घोल विघटित हो जाता है, जिससे कार्बन डाइऑक्साइड निकलता है। औद्योगिक उत्पादन में, इसे सिलेंडर में पंप किया जाता है। प्रयोगशाला स्थितियों में, एसिड के साथ कार्बोनेट और बाइकार्बोनेट की बातचीत से छोटी मात्रा में प्राप्त किया जाता है, उदाहरण के लिए हाइड्रोक्लोरिक एसिड के साथ संगमरमर। आवेदन रासायनिक उद्योग कार्बन डाइऑक्साइड का उपयोग सिंथेटिक रसायनों के उत्पादन और रिएक्टर तापमान के नियमन में किया जाता है। CO2 क्षारीय अपशिष्ट जल को बेअसर करने का कार्य भी करता है। सुपरक्रिटिकल परिस्थितियों में, कार्बन डाइऑक्साइड का उपयोग पॉलिमर, पशु या वनस्पति फाइबर की सफाई या सुखाने में किया जाता है। औषध बनाने की विद्या कार्बन डाइऑक्साइड का उपयोग एक निष्क्रिय वातावरण बनाने के लिए किया जाता है, रसायनों का संश्लेषण, सुपरक्रिटिकल द्रव निष्कर्षण (एसएफई), अपशिष्ट जल या उत्पाद का अम्लीयता (पीएच) इसके कम तापमान परिवहन (°78 ° C या °108 ° F) के दौरान। खाद्य उद्योग खाद्य उद्योग में CO2 के निम्नलिखित मुख्य उपयोगों पर प्रकाश डाला गया है: सॉफ्ट ड्रिंक, मिनरल वाटर और बीयर सहित कार्बोनेटेड पुतलों की संतृप्ति। खाद्य पैकेजिंग - गैस के निष्क्रिय और जीवाणुनाशक गुणों को कई खाद्य उत्पादों (IG ALIGAL ™) के शैल्फ जीवन को बढ़ाने के लिए नाइट्रोजन मिश्रण (एक संशोधित वातावरण में पैकेजिंग) में सफलतापूर्वक उपयोग किया जाता है। खाद्य उत्पादों के वितरण (शुष्क बर्फ के रूप में) के दौरान शीतलन या ठंड (क्रायोजेनिक तरल के रूप में) और तापमान नियंत्रण की प्रक्रियाएं। कार्बन डाइऑक्साइड का उपयोग करके कॉफी से कैफीन का सुपरक्रिटिकल निष्कासन। दवा कृत्रिम अंगों पर संचालन करते समय, कार्बन डाइऑक्साइड शारीरिक के करीब वायुमंडलीय स्थितियों को बनाने का कार्य करता है। ऑक्सीजन या वायु मिश्रण के घटकों में से एक के रूप में, कार्बन डाइऑक्साइड गहरी साँस लेने के उत्तेजक के रूप में कार्य करता है। एक अन्य अनुप्रयोग इंट्रा-एब्डोमिनल इंसेफ्लाइटिस के लिए सर्जिकल डिलेटेशन है। धातुकर्म उद्योग धातु विज्ञान में कार्बन डाइऑक्साइड का सबसे लोकप्रिय उपयोग पर्यावरण संरक्षण है: CO2 का उपयोग कार्बन के स्क्रैप और इंजेक्शन भरने की प्रक्रिया में भूरे रंग के धुएं के निक्षेपण के लिए किया जाता है, विद्युत चाप भट्टियों के उद्घाटन के दौरान नाइट्रोजन अवशोषण की मात्रा को कम करने के लिए, साथ ही साथ नीचे मिश्रण के लिए भी। अलौह धातु प्रसंस्करण उद्योग मैट (Cu / Ni उत्पादन) या सिल्लियां (Zn / Pb उत्पादन) के बाल्टी परिवहन के दौरान धुएं को जमा करने के लिए कार्बन डाइऑक्साइड का उपयोग करता है। एसिड माइन के पानी को निकालने के दौरान पानी की पुनरावृत्ति में थोड़ी मात्रा में तरल कार्बन डाइऑक्साइड का उपयोग किया जा सकता है। CO2 लेजर को कार्बन डाइऑक्साइड (AL LASAL ™) के कुछ विशेष ग्रेड के उपभोक्ताओं के रूप में भी जाना जाता है। प्रयोगशाला अनुसंधान और विश्लेषण सुपरक्रिटिकल कार्बन डाइऑक्साइड एक मोबाइल चरण है जो क्रोमैटोग्राफिक विश्लेषण की प्रक्रिया और निष्कर्षण प्रक्रियाओं में दोनों का उपयोग किया जाता है। लुगदी और कागज उद्योग लकड़ी के गूदे या सेल्यूलोज के क्षारीय विरंजन के बाद, कार्बन डाइऑक्साइड आपको संसाधित कच्चे माल में पीएच स्तर को सटीक रूप से नियंत्रित करने की अनुमति देता है। CO2 का उपयोग पिघले तेल को बेअसर करने और कागज मशीनों की उत्पादकता बढ़ाने के लिए प्रक्रियाओं में किया जा सकता है। इलेक्ट्रानिक्स कार्बन डाइऑक्साइड का उपयोग आमतौर पर अपशिष्ट जल उपचार के लिए किया जाता है, और पर्यावरणीय प्रभावों के लिए इलेक्ट्रॉनिक उपकरणों का परीक्षण करते समय इसका उपयोग शीतलन माध्यम के रूप में किया जाता है। इसके अलावा, कार्बन डाइऑक्साइड अल्ट्राप्रुट पानी की चालकता को बढ़ा सकता है, और बर्फ के रूप में इसका उपयोग भागों की घर्षण सफाई या क्रिस्टलीय प्लेटों पर जमा हटाने के लिए किया जाता है। इसके अतिरिक्त, कार्बन डाइऑक्साइड को कार्बनिक सॉल्वैंट्स के उपयोग के बिना क्रिस्टलीय प्लेटों से फोटोक्यूरेबल सामग्री को हटाने के लिए पर्यावरण के अनुकूल सुपरक्रिटिकल तरल पदार्थ के रूप में इस्तेमाल किया जा सकता है। पर्यावरण संरक्षण कार्बन डाइऑक्साइड का अतिरिक्त आपको तरल अपशिष्टों में आवश्यक पीएच स्तर को बनाए रखने की अनुमति देता है। पीएच नियामक के रूप में, यह सल्फ्यूरिक एसिड का एक उत्कृष्ट विकल्प है। पंजीकरण के तरीके कार्बन डाइऑक्साइड के आंशिक दबाव का मापन तकनीकी प्रक्रियाओं में, चिकित्सा अनुप्रयोगों में - यांत्रिक वेंटिलेशन के दौरान श्वसन मिश्रण के विश्लेषण और बंद जीवन समर्थन प्रणालियों में आवश्यक है। कार्बन डाइऑक्साइड को अवरक्त स्पेक्ट्रोस्कोपी और अन्य गैस मापन प्रणालियों के सिद्धांत के आधार पर गैस विश्लेषक का उपयोग करके दर्ज किया गया है। एक्सहैल्ड हवा में कार्बन डाइऑक्साइड की सामग्री को रिकॉर्ड करने के लिए एक मेडिकल गैस एनालाइज़र को कैपनोग्राफ कहा जाता है। वातावरण में सीओ 2 की एकाग्रता का विश्लेषण पर्यावरण और वैज्ञानिक अनुसंधान के लिए उपयोग किया जाता है, ताकि ग्रीनहाउस प्रभाव का अध्ययन किया जा सके। कार्बन डाइऑक्साइड को नुकसान पहुंचाता है ग्रीनहाउस गैसों में से एक के रूप में, कार्बन डाइऑक्साइड प्रक्रिया में शामिल है। ग्लोबल वार्मिंग। औद्योगिक युग की शुरुआत से वायुमंडल में इस गैस के स्तर में निरंतर वृद्धि देखी गई है। कार्बन डाइऑक्साइड का रासायनिक सूत्र सीओ 2 है। कार्बन डाइऑक्साइड - एक ऐसा पदार्थ जिसके कई नाम हैं: कार्बन मोनोऑक्साइड (IV), कार्बन डाइऑक्साइड या कार्बन डाइऑक्साइड। इसे कार्बोनिक एनहाइड्राइड भी कहा जाता है। यह एक पूरी तरह से रंगहीन गैस है जो गंधहीन होती है, खट्टा स्वाद के साथ। कार्बन डाइऑक्साइड हवा से भारी है, पानी में घुलनशील है। -78 ° C से नीचे के तापमान पर क्रिस्टलाइज़ हो जाता है और बर्फ जैसा हो जाता है। कार्बन डाइऑक्साइड 16 वीं शताब्दी के रसायनशास्त्री वैंट हेलमॉन्ट द्वारा "वाइल्ड गैस" नाम के तहत हवा के साथ विपरीत सभी अन्य गैसों के बीच पहला था। सीओ 2 की खोज ने रसायन विज्ञान की एक नई शाखा - न्यूमेटोकेमिस्ट्री (गैस रसायन विज्ञान) की नींव रखी। 1754 में स्कॉटिश केमिस्ट जोसेफ ब्लैक (1728-1799) ने स्थापित किया कि गर्म होने पर गैस बनाने वाला खनिज खनिज (कैल्शियम कार्बोनेट) विघटित होता है, जिससे गैस का निर्माण होता है और क्विकटाइम (कैल्शियम ऑक्साइड) बनता है: सीएसीओ 3 सीएओ + सीओ 2 विकसित गैस को फिर से कैल्शियम ऑक्साइड के साथ जोड़ा जा सकता है और कैल्शियम कार्बोनेट को फिर से प्राप्त किया जाता है: काओ + सीओ 2 सीएसीओ ३ यह गैस वान हेलमोंट द्वारा खोजी गई "जंगली गैस" के समान थी, लेकिन ब्लैक ने इसे एक नया नाम दिया - "बाध्य वायु" - क्योंकि यह गैस बाध्य हो सकती है और एक ठोस पदार्थ, कैल्शियम कार्बोनेट, फिर से प्राप्त किया जा सकता है। कुछ साल बाद, कैवेंडिश ने दो और विशेषताओं की खोज की भौतिक गुण कार्बन डाइऑक्साइड - इसका उच्च घनत्व और पानी में महत्वपूर्ण घुलनशीलता। 60 गुना अधिक कार्बन डाइऑक्साइड समुद्र और महासागरों में विघटित रूप में निहित है। प्रत्येक वर्ष के दौरान, दुनिया की वनस्पति में निहित कुल सीओ 2 का लगभग 1/50 प्रकाश संश्लेषण की प्रक्रिया में वायुमंडल से निकाला जाता है, जो खनिज पदार्थों को कार्बनिक में परिवर्तित करता है। प्रकृति में कार्बन डाइऑक्साइड का थोक कार्बनिक पदार्थों के अपघटन की विभिन्न प्रक्रियाओं के परिणामस्वरूप बनता है। कार्बन डाइऑक्साइड पौधों, जानवरों और सूक्ष्मजीवों के श्वसन के दौरान जारी किया जाता है। विभिन्न उद्योगों द्वारा उत्सर्जित कार्बन डाइऑक्साइड की मात्रा लगातार बढ़ रही है। कार्बन डाइऑक्साइड ज्वालामुखीय गैसों में निहित है, यह भी ज्वालामुखी क्षेत्रों में पृथ्वी से जारी किया गया है। ग्लोब के बाहर, कार्बन मोनोऑक्साइड (IV) मंगल और शुक्र के वायुमंडल में पाया गया था - "स्थलीय प्रकार" ग्रह। उद्योग में, कार्बन डाइऑक्साइड मुख्य रूप से चूना पत्थर, मादक किण्वन, आदि के उप-उत्पाद के रूप में प्राप्त किया जाता है। लैब में हो रही है रासायनिक प्रयोगशालाओं में, वे या तो तरल कार्बन डाइऑक्साइड के साथ तैयार सिलेंडर का उपयोग करते हैं, या उन्हें संगमरमर के टुकड़ों पर हाइड्रोक्लोरिक एसिड की कार्रवाई से गैसों के उत्पादन के लिए किप के तंत्र या उपकरण में सीओ 2 मिलता है: CaCO 3 + 2HClCaCl 2 + CO 2 + H 2 O भौतिक गुण CO 2 एक रंगहीन गैस, गंधहीन और हवा से 1.5 गुना भारी है। पानी में कार्बन डाइऑक्साइड की अच्छी घुलनशीलता "पानी के विस्थापन" की विधि द्वारा इसे इकट्ठा करना असंभव बनाता है। रासायनिक गुण कार्बन मोनोऑक्साइड अम्लीय गुण, और जब यह गैस पानी में घुल जाती है, तो कार्बोनिक एसिड बनता है। जब रंगा हुआ लिटमस पानी के माध्यम से सीओ 2 गुजर रहा है, तो वायलेट से लाल तक संकेतक के रंग परिवर्तन का निरीक्षण किया जा सकता है। गुणवत्ता की प्रतिक्रिया हवा में कार्बन डाइऑक्साइड की सामग्री कैल्शियम हाइड्रॉक्साइड (चूने के पानी) के एक पतला समाधान के माध्यम से गैस का मार्ग है। अंजीर। 1. कार्बन डाइऑक्साइड इस समाधान में अघुलनशील कैल्शियम कार्बोनेट के गठन का कारण बनता है, जिसके परिणामस्वरूप समाधान बादल बन जाता है: सीओ 2 + सीए (ओएच) 2 सीएसीओ 3 + एच 2 ओ
अंजीर। 1. कार्बन डाइऑक्साइड से गुजरने पर चूने के पानी की टर्बिडिटी जब सीओ 2 की अधिक मात्रा डाली जाती है, तो घुलनशील कैल्शियम बाइकार्बोनेट में अघुलनशील कार्बोनेट के रूपांतरण के कारण बादल का घोल फिर से पारदर्शी हो जाता है: सीएसीओ 3 + एच 2 ओ + सीओ 2 सीए (एचसीओ 3) 2 कैल्शियम बाइकार्बोनेट 1. दबाए गए ठोस कार्बन डाइऑक्साइड को "सूखी बर्फ" कहा जाता है। सॉलिड सीओ 2 को सघन घने बर्फ की तरह है, कठोरता में चाक की याद ताजा करती है। अंजीर। 2. "सूखी बर्फ" का तापमान -78 डिग्री सेल्सियस है। सूखी बर्फ, पानी की बर्फ के विपरीत, घनी होती है। वह पानी में डूब जाता है, अचानक ठंडा हो जाता है। सूखी बर्फ के कई टुकड़ों को लौ में फेंककर पेट्रोल को जल्दी से बुझाया जा सकता है।
अंजीर। 2. "सूखी बर्फ" मुख्य बात है सूखी बर्फ आवेदन - भोजन का भंडारण और परिवहन : मछली, मांस, आइसक्रीम, आदि। शुष्क बर्फ का मूल्य न केवल इसके शीतलन प्रभाव में निहित है, बल्कि इस तथ्य में भी है कि कार्बन डाइऑक्साइड में उत्पादों को ढालना नहीं है और सड़ांध नहीं है। 2. सूखी बर्फ को भागों, उपकरणों, तंत्रों के लिए प्रयोगशालाओं में परीक्षण किया जाता है जो कम तापमान पर काम करेंगे। सूखी बर्फ का उपयोग कारों पर रबड़ के टायर के ठंढ प्रतिरोध का परीक्षण करने के लिए किया जाता है। 3. कार्बन डाइऑक्साइड का उपयोग फल और खनिज पानी को कार्बोनेट करने के लिए, और कार्बन डाइऑक्साइड स्नान के लिए दवा में किया जाता है। 4. कार्बन डाइऑक्साइड आग बुझाने वाले यंत्रों में तरल कार्बन डाइऑक्साइड का उपयोग किया जाता है। यह उन मामलों में विशेष रूप से प्रभावी है जहां पानी अनुपयुक्त है, उदाहरण के लिए, जब ज्वलनशील ज्वलनशील तरल पदार्थ को बाहर करना या जब कमरे में एक ऑफ-लाइन वायरिंग या अद्वितीय उपकरण होते हैं जो पानी से क्षतिग्रस्त हो सकते हैं। संदर्भ
घर का पाठ
|


