Кислотно основные свойства углекислого газа. Физические свойства углекислоты. Получение низких температур
И. Г. Хомченко, А. В. Трифонов, Б. Н. Разуваев. "Современный аквариум и химия". г. Москва, "Новая волна".
ОБ УГЛЕКИСЛОМ ГАЗЕ И КАРБОНАТАХ
Важную роль в аквариумных процессах играет оксид углерода (IV ) или, как его чаще называют, углекислый газ. Он представляет собой соединение углерода с кислородом; в молекуле вещества один атом углерода связан с двумя атомами кислорода - CO 2 . Углекислый газ влияет на гидрохимические параметры воды (жесткость, pH, содержание различных веществ), он действует на рыб и других водных животных и играет важнейшую роль в развитии аквариумных растений.
В атмосферных условиях стандартной температуры и давления углекислый газ является газом. Он бесцветен и не имеет запаха и представляет собой небольшую составляющую воздуха. Хотя его концентрация в воздухе незначительно изменяется, типичная концентрация в воздухе составляет около 3, 38% или 380 м.д.
Фламандскому ученому Яну Баптисте ван Хелмонту приписывают открытие углекислого газа. Он определил газ, который был образован во время сжигания древесины, который сегодня известен как двуокись углерода. Его открытие было важно не только для открытия газа, но и потому, что он впервые понял, что воздух представляет собой комбинацию газов. Шотландский ученый Джозеф Блэк также много изучил углекислый газ и обнаружил, что он выдыхается при дыхании человека.
Углекислый газ, как мы уже отмечали, хорошо растворим в воде; при температуре 20°C в 100 г воды может раствориться 87,8 мл, или 172 мг CO 2 . Это значительно больше, чем растворимость таких газов, как кислород, водород, азот и др. (см. табл. 1).
Растворение CO 2 в воде связано с химическим взаимодействием его молекул с водой, приводящее к возникновению угольной кислоты:
Благодаря своим свойствам углекислый газ имеет много практических и промышленных применений. Замороженный диоксид углерода известен как «сухой лед». При оттаивании в атмосферных условиях он не проходит через жидкую стадию, а непосредственно переходит в газ.
Сухой лед полезен в качестве охлаждающего агента и может сохранять замороженные продукты в морозильной камере во время сбоя питания. В производстве и строительстве двуокись углерода используется в качестве защитного газа при сварке, поскольку газ защищает расплавленную сварочную ванну от окисления окружающим воздухом. Поскольку диоксид углерода является реакционноспособным и может вызвать некоторое окисление, обычно используют смесь двуокиси углерода и аргона, инертного газа.
CO 2 + H 2 O == H 2 С O 3
Угольная кислота неустойчива, она может распадаться, поэтому часть растворенного в воде CO 2 находится в свободном состоянии. Это слабая кислота, т. е. она диссоциирует на ионы в незначительной степени:
H 2 С O 3 = H + + HCO 3 ‾
Так, в растворе, в котором содержится 100 мл CO 2 в 1 л воды, приблизительно одна молекула из 50 диссоциирует на ионы. Очень малая часть образовавшихся гидрокарбонат-ионов HCO 3 ‾ может также распадаться:
Получение низких температур
В нефтяной промышленности углекислый газ используется для упрощения добычи из скважин. Он закачивается в лунки и частично растворяется в масле, уменьшая его вязкость, чтобы его можно было извлечь более легко. Двуокись углерода также используется в качестве аэрозольного пропеллента. Это более безопасная замена предыдущих хлорфторуглеродов, которые использовались в аэрозолях в прошлом и были названы причинами истощения озонового слоя в стратосфере Земли. Он используется в первую очередь в аэрозольных продуктах, предназначенных для доставки крупнозернистого аэрозоля с близкого расстояния, например, дезинфицирующих средств домашних хозяйств.
HCO 3 ‾ = H + + С O 3 2‾
В результате диссоциации угольной кислоты в воде концентрация ионов H + становится больше, чем ОН ‾ и среда приобретает кислую реакцию (pH < 7).
Углекислый газ - постоянный компонент воздуха. Обычно в 1 м 3 (1000 л) содержится около 300 мл CO 2 . В атмосфере жилых помещений содержание CO 2 может быть выше за счет дыхания людей. Если мы учтем среднее содержание углекислого газа в воздухе, то при использовании микрокомпрессора для продувания аквариума с производительностью 50 л/ч, ежечасно аквариум будет получать 15 мл CO 2 . Растворение CO 2 происходит и без продувки, за счет контакта поверхности воды с воздухом помещения. В этом случае, естественно, насыщение воды углекислым газом происходит значительно медленнее.
Углекислый газ также используется в огнетушителях, чтобы вытеснить кислород, необходимый для пожара. Углекислый газ используется, чтобы положить «шипение» в безалкогольные напитки. Это улучшает вкус напитка, а также увеличивает срок годности. В здравоохранении углекислый газ используется в качестве добавки к кислороду для обеспечения респираторного стимулятора.
В последние годы существует озабоченность по поводу двуокиси углерода как одного из «парниковых газов». Существует естественный баланс углекислого газа в атмосфере от активности растений, животных и бактерий. Парниковые газы, такие как углекислый газ, заставляют землю нагреваться, потому что поглощают излучение солнца. Двойные связи молекул углекислого газа поглощают излучение, а затем переносят его в кинетическую энергию, которая переизлучается в виде тепла, нагревая атмосферу. Это жизненно важно для всей жизни на Земле, но углекислый газ также образуется при сжигании ископаемых видов топлива, используемых для энергетики, и промышленная деятельность людей нарушает этот естественный баланс.
Другим источником CO 2 в аквариуме является газ, выделяемый при дыхании рыбами и другими водными организмами (улитками, насекомыми, рачками и др.).
Водные растения на свету поглощают (ассимилируют) CO 2 , превращая его в органические соединения - углеводы, глюкозу и др. Этот процесс получил название фотосинтеза, он обычно выражается уравнением;
Его концентрация в атмосфере Земли возросла более чем на 35%, поскольку многие мировые страны стали промышленно развитыми. Но даже этот темп роста также увеличивается. Американский ученый Чарльз Килинг был связан с Институтом океанографии Скриппса. Он начал систематически проводить ежемесячные измерения углекислого газа в атмосфере. Эти данные стали известны как «Кривая Килинга». Эта кривая ясно показывает, что количество углекислого газа в атмосфере увеличивается.
Действительно, многие основные исследования показывают, что земля нагревается. Последствия такого изменения температуры могут быть разрушительными. Океаны становятся более кислотными, что приводит к усилению эрозии береговых береговых линий. Наводнения и засухи, вызванные повышенными температурами, могут изменить и снизить урожайность сельскохозяйственных культур. Водный цикл уже начинает меняться, при осадке в течение наиболее интенсивных 1% штормов увеличилось почти на 20%.
|
6С O 2 +6 H 2 O = |
С 6 Н 12 O 6 |
6 O 2 |
|
глюкоза |
В темноте происходит обратный процесс:
В более теплом климате также увеличиваются потребности в энергии для кондиционирования воздуха и электроэнергии. Поэтому нетрудно понять, что значение углекислого газа выходит далеко за рамки его способности делать газированные напитки газированной воды. Помимо большого количества практических применений, он является частью чувствительного, естественного баланса, который эволюционировал, чтобы сделать возможной жизнь человека, растений и животных на земле. Тем, кто руководит человеческими обществами, было бы полезно принять знания о том, что углекислый газ - это газ, который необходимо понимать и заслуживает уважения.
С 6 Н 12 O 6 +6 O 2 =6 CO 2 +6 H 2 O
приводящий к увеличению содержания CO 2 в воде. Естественно, эти процессы будут оказывать тем более существенное влияние на гидрохимические процессы, чем больше растений содержится в аквариуме. Выделение углекислого газа растениями в ночное время может явиться причиной гибели рыб от удушья.
Это открытие подтвердило теорию о том, что диоксид углерода может существовать в стеклянном состоянии, подобном другим членам его элементарного семейства, таким как кремний и германий. Однако, в отличие от кремнеземных и германийских стаканов, углекислый газ не стабилен при нормальных давлениях и возвращается к газу, когда давление высвобождается.
В химической промышленности углекислый газ используется для производства мочевины, карбонатов и бикарбонатов и салицилата натрия. Углекислый газ иногда используется для пополнения винных бутылок или других емкостей для хранения, таких как бочки, чтобы предотвратить окисление, хотя у него есть проблема, что он может раствориться в вине, сделав ранее еще вином немного газированный. По этой причине другие газы, такие как азот или аргон, являются предпочтительными для этого процесса профессиональными виноделами.
Еще один источник CO 2 в аквариуме - выделение его при разложении (гниении и других процессах) различных органических веществ (старых листьев растений, останков рыб, избытка корма и т. п.).
Итак, углекислый газ в больших концентрациях токсичен для аквариумных животных. При большом содержании CO 2 в воде он попадает в кровь рыб, вызывая удушье. Для нормального функционирования аквасистемы концентрация CO 2 в аквариумной воде не должна превышать 4 мл/л.
Пятьсот миллионов лет назад углекислый газ был в 20 раз более распространенным, чем сегодня, уменьшившись до 4-5 раз в течение юрского периода, а затем продолжал медленное снижение вплоть до промышленной революции, причем особенно быстрое сокращение произошло 49 миллионов лет назад.
Согласно австралийскому Управлению по безопасности на море: Длительное воздействие умеренных концентраций может вызвать ацидоз и неблагоприятное воздействие на метаболизм кальция фосфора, что приводит к увеличению отложений кальция в мягких тканях. Углекислый газ токсичен для сердца и вызывает снижение сократительной силы. При концентрациях трех% воздуха в воздухе, он слабо наркотический и вызывает повышенное кровяное давление и частоту пульса, а также уменьшает слух. При концентрациях около пяти процентов по объему он вызывает раздражение дыхательного центра, головокружение, спутанность сознания и затрудненное дыхание головная боль и одышка.
В аквариумной практике приходится сталкиваться с необходимостью увеличения или уменьшения содержания углекислого газа в аквариумной воде. Увеличить концентрацию CO 2 в воде можно, увеличив количество рыб, содержащихся в аквариуме. Иногда, при выращивании большого числа водных растений (в декоративном аквариуме) рекомендуют продувание воды углекислым газом из баллона или выделяющимся при химических реакциях (например, между мелом и кислотой: CaCO 3 + 2HCl = CaCl 2 + CO 2 + H 2 O ) или брожении некоторых веществ, а также добавление раствора CO 2 (газированная вода). Все эти способы надо использовать очень осторожно, постоянно проводя анализ воды (измерять pH, dKH и содержание CO 2 ), чтобы не нанести вреда находящимся в аквариуме рыбам.
При концентрации около восьми процентов она вызывает головную боль, потливость, тусклое зрение, тремор и потерю сознания после воздействия в течение от пяти до десяти минут. Максимальный безопасный уровень для младенцев, детей, пожилых людей и лиц с сердечно-легочными проблемами здоровья значительно меньше. Снижение производительности или нормальной физической активности не происходит на этом уровне.
Эти цифры действительны для чистого диоксида углерода. В закрытых помещениях, занятых людьми, концентрация углекислого газа будет достигать более высоких уровней, чем в открытом воздухе на открытом воздухе. Шахтеры попытаются предупредить себя об опасных уровнях углекислого газа в шахте шахты, доставив с собой в клетку канарейку, когда они работали. Снижение связывания с углекислым газом в крови из-за повышенного уровня кислорода известно как эффект Холдейна и имеет важное значение для переноса углекислого газа из тканей в легкие.
Уменьшить содержание CO 2 в аквариумной воде можно, уменьшив количество рыб или увеличив интенсивность и длительность освещения, чтобы активировать ассимиляционную деятельность водных растений. Многие аквариумисты считают, что продувка воды в аквариуме воздухом при помощи микрокомпрессоров приводит к уменьшению содержания CO 2 за счет вытеснения его из воды растворенным воздухом, однако вытеснить некоторое количество CO 2 удается лишь при большом его содержании. Концентрация CO 2 , близкая к нормальной, практически не изменяется при такой продувке. Если же CO 2 в воде почти нет, то продувка атмосферным воздухом при помощи микрокомпрессоров приводит к увеличению содержания CO 2 в воде.
Об аквариумной воде и произведении растворимости
Хотя организму требуется кислород для метаболизма, низкий уровень кислорода не стимулирует дыхание. Скорее, дыхание стимулируется более высокими уровнями углекислого газа. В результате, дыхание воздуха низкого давления или газовой смеси без кислорода вообще может привести к потере сознания, никогда не испытывая воздушный голод. Авторские права.
Является бесцветным, без запаха газа, который является одним из наиболее распространенных газообразных материалов в мире. Он встречается почти везде в атмосфере Земли и играет важную роль во многих биологических процессах. Люди выделяют углекислый газ во время естественных метаболических процессов, в то время как растения используют углекислый газ во время. Он также используется во многих популярных вещах, включая газированные напитки, дрожжей и хлебобулочных изделий, а также «сухих» огнетушителей.
Важная роль CO 2 в гидрохимии аквариума состоит в установлении так называемого углекислотно-известкового равновесия. Это равновесие определяется главным образом тремя параметрами; концентрацией CO 2 в воде, значениями pH и карбонатной жесткости dKH .
Карбонат кальция CaCO 3 обладает очень плохой растворимостью в воде (7 мг в 1 л), что соответствует 2° жесткости. При растворении CO 2 в воде карбонаты, которые практически всегда содержатся в грунте, на чинают взаимодействовать с углекислым газом, с образованием гидрокарбонатов, которые хорошо растворимы в воде:
Свойства углекислого газа можно классифицировать по тому, описывают ли они физические, химические или экологические особенности этого газа. Физически углекислый газ очень стабилен и в значительной степени не подвержен влиянию, поскольку он взаимодействует со многими другими материалами в атмосфере. Однако физические свойства этого вещества могут варьироваться в зависимости от температуры. Хотя этот материал является газом в большинстве условий, углекислый газ образует твердое вещество при температурах ниже -70 градусов Цельсия.
Применение углекислого газа при сварке
Он также может превращаться в жидкость, когда он растворяется в воде при постоянном давлении. С химической или молекулярной точки зрения свойства двуокиси углерода довольно постоянны в широком диапазоне условий. Одна единица диоксида углерода всегда будет состоять из одного атома углерода, связанного с двумя атомами кислорода. Эта связь очень сильна и помогает сделать углекислый газ одной из самых стабильных из всех молекул.
CaCO 3 + CO 2 + H 2 O = Ca(HCO 3) 2
Насыщая воду углекислым газом, можно добиться очень высокого содержания гидрокарбонатов (жесткость может подняться до 50 O dGH). Если содержание углекислого газа в воде уменьшается, то происходит обратный процесс;
Ca(HCO 3) 2 = CaCO 3 + CO 2 + H 2 O
Преимущественное протекание одного из процессов определяется значением pH в аквариумной воде. В табл. 11 показано, как зависит содержание углекислого газа в аквариумной воде от водородного показателя и карбонатной жесткости воды.
Химические свойства диоксида углерода обычно связаны с его уровнем кислотности. В то время как большинство единиц углекислого газа являются немного кислотными по своей природе, уровень кислотности можно модифицировать путем растворения молекул в воде. Этот процесс осуществляется в лабораториях или промышленных объектах из-за узкоспециализированного характера этой работы.
Двуокись углерода считается видом газа. Парниковые газы способствуют глобальному потеплению путем улавливания тепла в атмосфере Земли. Поскольку тепло не может уйти, температура земли увеличивается, что может иметь разрушительные последствия для окружающей среды и всей жизни на Земле. Чтобы свести к минимуму последствия глобального потепления, люди могут работать, чтобы компенсировать или минимизировать выбросы углекислого газа. Один из способов сделать это - уменьшить нашу зависимость от топлива.
Таблица 11 Содержание углекислого газа в аквариумной воде (в мг/л) различной кислотности и карбонатной жесткости
|
pH 6 |
pH 6,5 |
pH 7 |
pH 7,5 |
pH 8 |
|
|
19,4 |
|||||
|
28,5 |
|||||
|
38,5 |
11,8 |
||||
|
58,0 |
17,7 |
||||
|
77,0 |
24,0 |
||||
|
96,0 |
30,0 |
||||
|
44,0 |
14,4 |
||||
|
59,0 |
19,4 |
Эта таблица показывает, сколько необходимо растворить а воде CO 2 , чтобы при определенной жесткости установить требуемое значение pH. В то же время значения pH и dKH позволяют приблизительно судить о количестве CO 2 , содержащемся в воде аквариума.
Однако кислотность и карбонатная жесткость не являются единственными факторами, определяющими углекислотно-известковое равновесие воды в аквариуме. Это равновесие зависит от целого ряда факторов:
1. Объем (вместимость аквариума). Как правило, в аквариумах большого объема равновесные процессы более устойчивы.
2. Геометрические размеры аквариума (соотношение длины, высоты и ширины). В аквариуме с большой площадью поверхности лучше осуществляется газообмен, с воздухом.
3. Количество рыб и других аквариумных животных, выделяющих углекислый газ при дыхании.
4. Количество растений в аквариуме, которые, в зависимости от освещенности, выделяют или поглощают углекислый газ.
5. Интенсивность освещения, влияющая на жизнедеятельность аквариумных растений.
6. Химический состав воды, наливаемой в аквариум. Наиболее важный фактор - карбонатная жесткость (dKH ).
7. Режим кормления рыб. Разлагающийся избыточный корм становится источником углекислого газа.
8. Температура воды. Влияет на растворимость карбонатов, углекислого газа, на скорость всех химических реакций.
9. Грунт. От содержания карбонатов в грунте зависит гидрохимический состав воды.
10. Движение воды за счет аквариумных фильтров, микрокомпрессоров, помп. Влияет на насыщение воды углекислым газом из воздуха и растворимость карбонатов.
Все указанные факторы говорят о сложной зависимости равновесия от условий содержания аквариума: из-за такого большого комплекса факторов часто бывает невозможно предугадать направление смещения углекислотно-известкового равновесия и соответствующее ему изменение гидрохимического состава аквариумной воды.
Расскажем подробнее о роли углекислого газа в жизнедеятельности растений. Как известно, растения состоят из органических соединений, т. е. соединений, основу (скелет) которых составляет углерод. Нарастание биомассы растений связано с необходимостью подпитки их извне соединениями углерода. Основным веществом, служащим для питания растений является углекислый газ. Растения ассимилируют (поглощают) CO 2 , превращая его в органические соеди нения - глюкозу, крахмал и другие (схема простейшего процесса описана выше).
Поглощение CO 2 связано с изменением pH среды: сдвигом его значения в щелочную сторону. Содержание углекислого газа в аквариумной воде, как мы видели из табл. 11, снижается при уменьшении жесткости и уменьшении кислотности воды. Поэтому очень мягкая и особенно щелочная вода неблагоприятны для растений. Многие аквариумные растения прекращают рост даже в слабощелочной среде (при pH около 8).
Забирая углекислый газ из воды, растения сами ухудшают условия своего существования; для их улучшения необходим новый источник углерода. Некоторые растения могут использовать в процессе фотосинтеза только свободный CO 2 , растворенный в воде. Если весь углекислый газ израсходован, то процесс фотосинтеза прекращается, и рост растения останавливается.
Некоторые представители гидрофлоры приспособились в отсутствие в воде свободного углекислого газа поглощать CO 2 из гидрокарбонатов кальция и магния, обусловливающих временную жесткость воды (биогенное умягчение воды). При этом происходят процессы?
Ca(HCO 3) 2 = CO 2 (поглощается растением) + CaCO 3 + H 2 O
Ca(HCO 3) 2 =2 CO 2 (поглощается растением)+ Ca(ОН) 2
В результате первой реакции образуются выпадающие в осадок карбонаты кальция и магния, образующие белый налет на листьях растений. В результате второй реакции, приводящей к более полному извлечению углерода из гидрокарбоната, образуется щелочь Ca(ОН) 2 , что влечет сильное увеличение pH. Например, элодея канадская (Elodea canadensis ) может настолько полно поглощать углекислый газ из растворенных гидрокарбонатов, что pH поднимается до 10 и даже несколько выше. В таких условиях большинство других водных растений погибает. Поглощение CO 2 из гидрокарбонатов, а, следовательно, и поглощение воды будет происходить тем интенсивнее, чем выше переменная (карбонатная) жесткость воды. Поэтому высокое значение dKH не может быть рекомендовано для аквариумов. По-видимому, предельная карбонатная жесткость dKH должна быть не больше 10-14.
Углекислый газ (двуокись углерода), называемый также углекислотой, - важнейший компонент в составе газированных напитков. Он обусловливает вкус и биологическую стойкость напитков, сообщает им игристость и освежающие свойства.
Химические свойства. В химическом отношении углекислый газ инертен. Образовавшись с выделением большого количества тепла, он, как продукт полного окисления углерода, весьма стоек. Реакции восстановления двуокиси углерода протекают только при высоких температурах. Так, например, взаимодействуя с калием при 230° С, углекислый газ восстанавливается до щавелевой кислоты:
Вступая в химическое взаимодействие с водой, газ, в количестве не более 1% от содержания его в растворе, образует угольную кислоту, диссоциирующую на ионы Н + , НСО 3 - , СО 2 3- . В водном растворе углекислый газ легко вступает в химические реакции, образуя различные углекислые соли. Поэтому водный раствор углекислого газа обладает большой агрессивностью по отношению к металлам, а также разрушающе действует на бетон.
Физические свойства. Для сатурации напитков используется углекислый газ, приведенный в жидкое состояние сжатием до высокого давления. В зависимости от температуры и давления углекислый газ может находиться также в газообразном и твердом состоянии. Температура и давление, соответствующие данному агрегатному состоянию, приведены на диаграмме фазового равновесия (рис. 13).
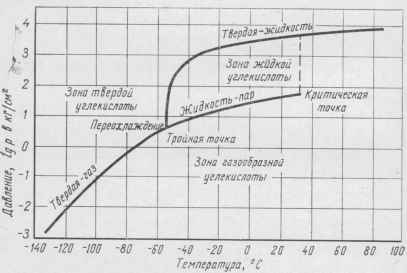
При температуре минус 56,6° С и давлении 0,52 Мн/м 2 (5,28 кГ/см 2), соответствующих тройной точке, углекислый газ может одновременно находиться в газообразном, жидком и твердом состоянии. При более высоких температуре и давлении углекислый газ находится в жидком и газообразном состоянии; при температуре и давлении, которые ниже этих показателей, газ, непосредственно минуя жидкую фазу, переходит в газообразное состояние (сублимирует). При температуре, превышающей критическую температуру 31,5° С, никакое давление не может удержать углекислый газ в виде жидкости.
В газообразном состоянии углекислый газ бесцветен, не имеет запаха и обладает слабовыраженным кислым вкусом. При температуре 0° С и атмосферном давлении плотность углекислого газа составляет 1,9769 кг/ж 3 ; он в 1,529 раз тяжелее воздуха. При 0°С и атмосферном давлении 1 кг газа занимает объем 506 л. Связь между объемом, температурой и давлением углекислого газа выражается уравнением:
где V - объем 1 кг газа в м 3 /кг; Т - температура газа в ° К; Р - давление газа в н/м 2 ; R - газовая постоянная; А - дополнительная величина, учитывающая отклонение от уравнения состояния идеального газа;
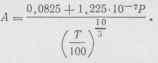
Ожиженный углекислый газ - бесцветная, прозрачная, легкоподвижная жидкость, напоминающая по внешнему виду спирт или эфир. Плотность жидкости при 0° С равна 0,947. При температуре 20°С ожиженный газ сохраняется под давлением 6,37 Мн/м 2 (65 кГ/см 2) в стальных баллонах. При свободном истечении из баллона жидкость испаряется с поглощением большого количества тепла. При снижении температуры до минус 78,5° С часть жидкости замерзает, превращаясь в так называемый сухой лед. По твердости сухой лед близок к мелу и имеет матово-белый цвет. Сухой лед испаряется медленнее жидкости, при этом он непосредственно переходит в газообразное состояние.
При температуре минус 78,9° С и давлении 1 кГ/см 2 (9,8 Мн/м 2) теплота сублимации сухого льда составляет 136,89 ккал/кг (573,57 кдж/кг).
